La stabilità di un reticolo cristallino, in condizioni di T e P costanti, è legata all’ energia libera di Gibbs di formazione del reticolo:
Se risulta più negativa per la formazione della struttura
che per quella della struttura
, la transizione
sarà spontanea e il solido avrà quella struttura.
Il processo di formazione del reticolo a partire da un gas di ioni è così esotermico che alla temperatura ambiente (298 K) il contributo entropico si può trascurare (l’effetto entropico dovuto alla temperatura diventa completamente trascurabile solo a temperature prossimo allo zero assoluto, T = 0 K) Si possono quindi discutere gli aspetti energetici reticolari sulla base dell sola entalpia di reticolo.
L’entalpia di dissociazione del reticolo cristallino o entalpia reticolare, (c per cristallo) è la variazione di entalpia standard che accompagna la formazione di un gas di ioni a partire dal solido corrispondente:
La dissociazione del reticolo cristallino è endotermica pertanto i valori di sono sempre positivi. La reazione contraria ovvero la formazione del cristallo
è altamente esotermica e quindi il valore di entalpia e’ negativo.
Il valore di si ricava da dati di entalpia attraverso il ciclo termodinamico di Born-Haber. Il ciclo di Born-Haber per la molecular di cloruro di sodio consiste nel ciclo termodinamico illustrato nella figura 1 e con i valori di entapia delle reazioni elencati nella Tabella I.
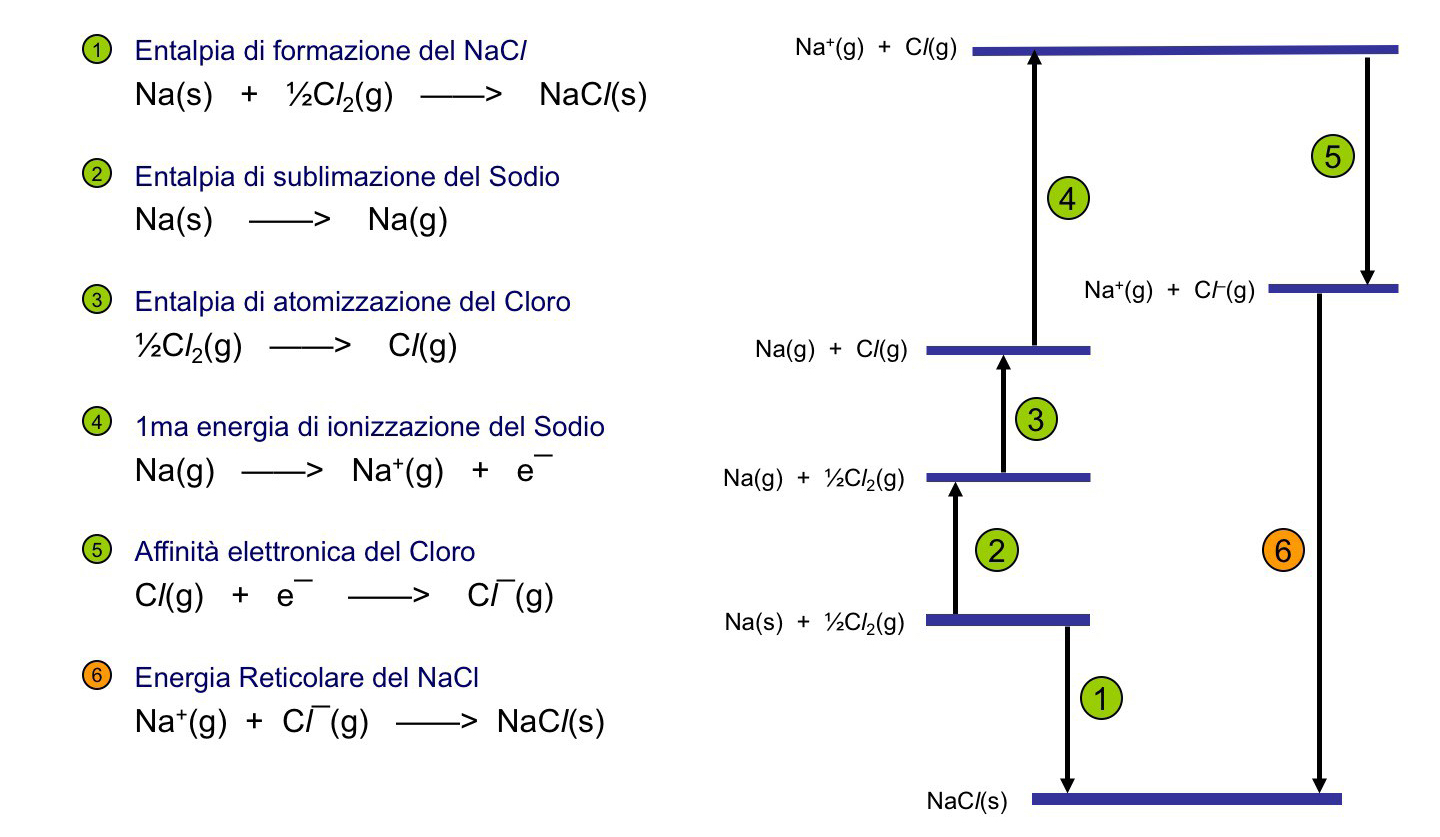

Essendo l’entalpia una funzione di stato, per la legge di Hess la somma della variazione entalpica lungo un ciclo completo deve essere nulla:
Pertanto, la somma delle entalpie `e data da da cui
. L’entalpia reticolare è l’opposto di questa variazione di entalpia,
.
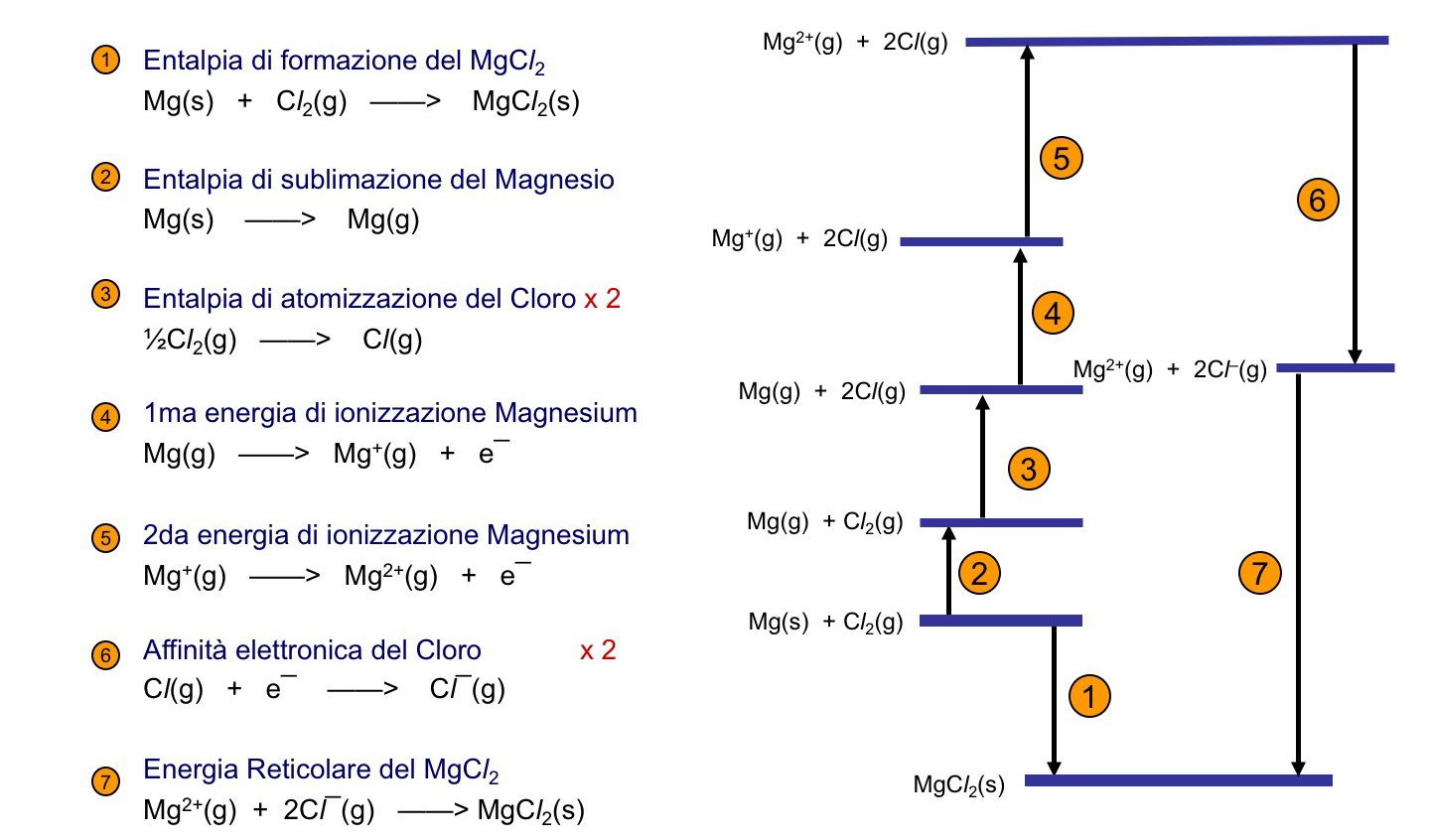
Nella tabella 2 sono elencate le reazioni per il calcolo dell’energia di formazione del .

In questo caso, la somma delle entalpie è data da (x +724) kJ mol da cui x = – 724 kJ mol
. L’entalpia reticolare è l’opposto di questa variazione di entalpia,
.
Come ultimo esempio, nella Figure 2, e’ mostrato il ciclo per il In questo caso, l’entalpia di atomizzazione l’affinita’ elettronica del Cloro dvono essere calcolati due volte.
L’entalpia reticolare consente di valutare la natura del legame presente nel solido. Se il valore calcolato col modello ionico, come vedremo, si accorda bene con quello sperimentale, è lecito adottare per il composto un modello di tipo fondamentalmente ionico. L’eventuale discrepanza è significativa di un certo grado di covalenza.
Per calcolare l’entalpia reticolare di un composto ionico bisogna considerare i diversi contributi alla sua energia, quali:
- Le attrazioni e le repulsioni elettrostatiche degli ioni; (https://wordpress.com/post/daniloroccatano.wordpress.com/1489).
- Le interazioni dispersione: per ioni di limitata polarizzabilità questo contributo è solo l’1% circa del contributo elettrostatico.
- Le forze repulsive dovute alla sovrapposizione delle distribuzioni elettroniche. Le interazioni repulsive fra ioni sono essenziali alla stabilità del solido ionico; in assenza di interazioni repulsive, i cationi e gli anioni si unirebbero, cioè collasserebbero. A
(quando non esiste agitazione termica e, quindi, non vi è energia cinetica nucleare), gli ioni adottano distanze tali che le attrazioni compensano le interazioni repulsive.
- L’energia cinetica derivante dai moti di vibrazione degli ioni può essere trascurata (ad eccezione del contributo dell’energia di punto zero) se consideriamo il solido allo zero assoluto.
In Tabella sono riportati alcuni valori di calcolati da D. Cubicciotti (J. Chem. Phys., 31, 1646, 1959), usando un accurato modello modello che tiene conto dei contributi menzionati.
Un accordo accettabile col dato sperimentale significa che il composto è ionico; un accordo insoddisfacente vuol dire che ci si trova dinanzi a un grado significativo di covalenza.
TAVOLA III: Entalpie reticolari misurate e calcolate.
| Composto | |||
| (calcolato) | (sperimentale) | ||
| LiF | 1033 | 1037 | 0.4 |
| LiCl | 845 | 852 | 0.8 |
| LiBr | 798 | 815 | 2.1 |
| LiI | 740 | 761 | 2.8 |
| NaF | 915 | 926 | 1.2 |
| NaCl | 778 | 786 | 1.0 |
| NaBr | 739 | 752 | 1.7 |
| NaI | 692 | 705 | 1.8 |
| KF | 813 | 821 | 1.0 |
| KCl | 709 | 717 | 1.1 |
| KBr | 680 | 689 | 1.3 |
| KI | 640 | 649 | 1.4 |
| RbF | 778 | 789 | 1.4 |
| RbCl | 686 | 695 | 1.3 |
| RbBr | 659 | 668 | 1.3 |
| RbI | 622 | 632 | 1.6 |
| CsF | 748 | 750 | 0.3 |
| CsCl | 652 | 676 | 3.6 |
| CsBr | 632 | 654 | 3.4 |
| CsI | 601 | 620 | 3.1 |
| CuCl | 904 | 993 | 9.0 |
| CuBr | 870 | 976 | 10.9 |
| CuI | 833 | 963 | 13.5 |
| AgF | 920 | 969 | 5.1 |
| AgCl | 833 | 912 | 8.7 |
| AgBr | 816 | 900 | 9.3 |
| AgI | 778 | 886 | 12.2 |
| TlCl | 686 | 748 | 8.3 |
| TlBr | 665 | 732 | 9.2 |
| TlI | 636 | 707 | 10.0 |
La differenza percentuale (ultima colonna) tra il valore sperimentale e calcolato mostra chiaramente che gli alogenuri dei metalli alcalini manifestano un buon accordo quando l’alogeno è poco polarizzabile (come il fluoruro, ) e minore quando è molto polarizzabile come lo ioduro
).
La peggiore differenza si riscontra con combinazioni di un catione e anione entrambi molto polarizzabili , quali CuI, AgI e TlI. Questi composti sono sostanzialmente covalenti, e quindi non si conformano con modelli che tengono conto solo dell’effetto elettrostatico.
If you have found interesting and useful my article, do not forget to press “Like it” and subscribe for updates on new ones!

Ma qual è la differenza tra energia e entalpia reticolare?
LikeLike
Questa è una buona domanda. Con energia reticolare si ci riferisce all’energia interna del cristallo, anche nota come energia di coesione. L’entalpia reticolare è pari all’energia interna addizionata al contributo PV (pressione x volume). A pressione atmosferica il termine PV può essere considerato trascurabile, pertanto il ciclo Born-Haber permette di misurare sperimentalmente l’energia di coesione del cristallo.
LikeLike
Ma io quando provo a fare la somma delle varie entalpie e poi le uguaglio a zero ottengo questo numero: -411+108+121+500-(-349)=667 kJ /mol
Ho visto che il calcolo dell’energia reticolare è anche legata all’energia di london, di madelung e di repulsione interelettronica.
Forse ho capito male.. 😦
LikeLike
Ti ringrazio per il commento. Ho appena notato che c’e’ un errore tipografico nella formula (5) e il DH6 e’ ripetuto due volte: l’ultimo DH non e’ DH6 ma DH1 per cui devi sottrarre il valore -411 (che diventa positivo.
LikeLike
Grazie per la risposta .
Come mai nel calcolo delle varie entalpie non hai inserito anche quelle relative a quella di London , Medelung e quelle relative alla repulsione elettronica?
Alla fine nella formazione di un cristallo bisogna tener conto delle interazioni tra gli ioni no?
LikeLike
L’entalpia reticolare che calcoli con il ciclo di Born-Haber contiene la somma di tutti i contributi che hai elencato. Il ciclo ti consente di calcolarne il valore da misure sperimentali indirette. I contributi dei singoli termini che elenchi possono essere solo stimati per via teorica, tenendo conto della loro somma.
LikeLike
Ok grazie !
Un’altra cosa che volevo sapere è la seguente:
L’energia potenziale in funzione della distanza interatomica di due particelle ioniche dipende dalla somma dell’energia attrattiva E(a) e dall’energia repulsiva E(r).
E= E(a) + E (r)
L’energia complessiva E, è l’energia reticolare in un cristallo ionico?
LikeLike
L’energia reticolare e’ l’energia che tiene insieme un cristallo ionico, l’energia di legame e’ un termine piu’ generale che usualmente si riferisce a legami covalenti. Per cui un cristallo ionico di una molecole ioniche (pensa al carbonato di calcio) ha una energia reticolare che tiene insieme il cristallo ma anche delle energie di legame che dengono insieme gli ioni molecolari.
LikeLike
Sto preparando Scienza dei Materiali e non riesco a capire come trovare l’energia di legame nel composto KCl. Pensavo fosse uguale a quella reticolare , ma a questo punto non so come continuare.
LikeLike
Penso che quello che cerchi sia l’energia del legame ionico della molecola (KCl) in fase gassosa. In questo caso, come mi hai scritto precedentemente devi tenere in conto le forze di attrazione e repulsione (in prima approssimazione puoi usare solo il termine elettrostatico se conosci la distanza di legame) ma anche l’energia necessaria a creare gli ioni dagli atomi di K e Cl. L’energia reticolare tiene in conto la formazione del solido a partire dalle molecole in fase gassosa (guarda i valori nel esempio del ciclo di Born-Haber).
LikeLike
La somma dei due termini deve essere estesa a tutti gli atomi/molecole nel cristallo che si assume composto da un numero di avogadro di molecole.
Posso farterti anche io una domanda? Immagino che sei uno studente universitario,
che esame stai preparando?
LikeLike
A livello teorico quindi l’energia di legame ionico di una generica molecola da cosa è data?
1) Ionizzazione del primo elemento
2) Ionizzazione del secondo elemento
3) Energia di attrazione coulombiana tra i due elementi?
LikeLike
E il termine repulsivo altrimenti i due ioni collassano in un punto. Sei hai la funzione di potenziale sei vicino alla soluzione. Usa le tue conoscenze di Analisi I per trovare la soluzione e in bocca al lupo per il tuo esame.
LikeLike